24 de noviembre de 2021 | COVID-19, influencia de la industria
Por Maryanne Demasi, PhD
Los ensayos controlados de fase III se consideran el «estándar de oro» para evaluar la eficacia y seguridad de las vacunas en humanos.
Estos son los ensayos en los que las autoridades han asegurado al público que las vacunas Covid-19 son «seguras y efectivas».
Los beneficios de las vacunas para reducir la gravedad de la enfermedad y las hospitalizaciones son bien conocidos, pero ¿qué sabemos sobre los eventos adversos?
Los datos sobre eventos adversos son vitales para la toma de decisiones efectiva por parte de reguladores, legisladores, médicos y pacientes.
Pero existen serias preocupaciones sobre el sesgo de publicación o la omisión selectiva de datos, por lo que es menos probable que se publiquen los eventos adversos que los resultados positivos.
Una revisión sistemática en la revista PLOS analizó 28 estudios y encontró que era menos probable que los eventos adversos aparecieran en artículos de revistas publicados que en estudios no publicados (por ejemplo, datos de la industria).
Los expertos ahora sugieren que los ensayos fundamentales de la vacuna Covid-19 pueden haber sido eventos adversos notificados de varias maneras.
Monitoreo virtual con aplicaciones digitales
En los ensayos de vacunas de Pfizer y AstraZeneca, los participantes recibieron aplicaciones digitales para registrar eventos adversos de forma remota, una forma más conveniente, eficiente en el tiempo y rentable de recopilar datos de pacientes.
Sin embargo, un problema importante es que las opciones predeterminadas en las aplicaciones digitales tienen un enfoque limitado en eventos adversos particulares.
Por ejemplo, la aplicación solo permite que un participante registre lo que la empresa considera eventos ‘esperados’ como fiebre, dolor en el lugar de la inyección, temperatura, enrojecimiento, hinchazón, fatiga, dolor de cabeza, diarrea, escalofríos, dolor muscular y articular.
Pero si experimentan un evento adverso grave como miocarditis o signos tempranos de mielitis transversa, síndrome de Guillain-Barré, un trastorno miopático, miocarditis o trombosis, no tienen la opción de registrarlo en la aplicación.
Caso en cuestión: Brianne Dressen, participante en el ensayo AstraZeneca (AZD1222) . Sufrió un evento adverso grave después de su primera inyección y quedó discapacitada.

Pero la aplicación de su teléfono inteligente no le permitió registrar el tipo particular de evento adverso, ni tampoco le permitió registrar sus síntomas con sus propias palabras.
Una vez hospitalizada, la Sra. Dressen fue ‘despegada’ del juicio. Se le informó que se le había administrado la vacuna AstraZeneca, no el placebo, y se le aconsejó que no se aplicara la segunda inyección.
Posteriormente, los investigadores «retiraron» a la Sra. Dressen del juicio, deshabilitaron la aplicación de su teléfono inteligente y todos sus datos a partir de ese día nunca fueron documentados a pesar de que todavía padece una discapacidad en la actualidad.
A la Sra. Dressen le preocupaba la falta de información sobre su evento adverso (y otros) en la publicación del ensayo en el New England Journal of Medicine de primer nivel .
Escribió al editor en jefe de la revista, el Dr. Eric Rubin, con el fin de «solicitar que se corrijan las inexactitudes en la publicación del ensayo y exigir un informe completo de la publicación y los resultados del ensayo».

El Dr. Rubin se negó a corregir los datos inexactos de su diario. El intercambio de correo electrónico completo se ha hecho público .
Si los fabricantes de vacunas retiran selectivamente a los sujetos que experimentan eventos adversos graves (como en el caso de Brianne Dressen y otros), puede explicar por qué los ensayos encontraron en su mayoría aumentos «estadísticamente significativos» en los eventos adversos menores (fiebre, escalofríos, dolores de cabeza) pero no en los graves. daños.
Culpar a una condición subyacente
Cuando Pfizer reclutó a niños de 12 a 15 años para su ensayo de vacuna de ARNm, los datos publicados en el New England Journal of Medicine indicaron que «no hubo eventos adversos graves relacionados con la vacuna».
Una de las participantes en el ensayo fue Maddie De Garay, de 13 años. Fue asignada al azar al grupo de la vacuna y, después de su primera inyección, la Sra. De Garay sufrió una reacción adversa grave, dejándola en una silla de ruedas y alimentada por una sonda nasogástrica.

Fue remitida al hospital para una evaluación completa y un médico diagnosticó a la Sra. De Garay con un «trastorno funcional».
En pocas palabras, este médico decidió que una predisposición a la «histeria» era la culpable de su discapacidad física, no de la vacuna, y sobre esta base, la remitieron a un centro de salud mental.
El Dr. David Healy, psiquiatra con sede en Ontario, Canadá, realizó posteriormente una revisión exhaustiva de los registros médicos de la Sra. De Garay, incluida una entrevista con su familia, y no encontró antecedentes de afecciones preexistentes o enfermedades mentales.

“Esta designación de ensayo no solo es incorrecta, sino bastante increíble”, dijo el Dr. Healy, quien temía que el diagnóstico erróneo pusiera en peligro el tratamiento y el progreso de la Sra. De Garay.
“Quizás sea incluso sociópata, ya que parece que, para mantener la posición de Pfizer, esta joven no está recibiendo el tratamiento que normalmente estaría indicado para el tipo de problemas que tiene. En lugar de ello, basándose en un supuesto ‘trastorno funcional’, la han enviado a un centro de salud mental ”, dijo el Dr. Healy.
“Si existe alguna posibilidad de que tenga una afección preexistente, entonces no culpan a la vacuna”, dice. “Y, por lo tanto, pueden afirmar que no hubo eventos graves relacionados con la vacuna porque no creen que su reacción esté ‘relacionada con la vacuna’. Es bastante increíble «.
El Dr. Healy dice que lo ha visto antes, en el Estudio 329 , que analizó los antidepresivos (ISRS) en niños y adolescentes. Un niño de 15 años fue retirado del ensayo después de que le diagnosticaran una “enfermedad intercurrente”.
Fue solo por casualidad que más tarde, el Dr. Healy descubrió que el participante del ensayo desarrolló comportamientos homicidas dos semanas después de tomar el ISRS, que el Dr. Healy dice que casi con certeza fue inducido por la droga.
Pero debido a que el niño fue diagnosticado con una “enfermedad intercurrente” en el ensayo, significó que los investigadores no tuvieron que escribir una narrativa explicando por qué este paciente fue retirado del ensayo.
En el ensayo de fase III de AstraZeneca de su vacuna, en el que participó Brianne Dressen, indicó el estudio ;
«Las muertes que fueron adjudicadas como no relacionadas con Covid-19 fueron tratadas como eventos intercurrentes y, por lo tanto, censuradas en la fecha de la muerte».
El Dr. Healy dijo: “Esto bien puede ser un sumidero en el que se han desvanecido las muertes por la vacuna. Los pacientes con accidentes cerebrovasculares, ataques cardíacos o eventos trombóticos pueden haber desaparecido aquí, con la justificación de que deben haber tenido un corazón defectuoso u otra enfermedad preexistente [o intercurrente] «.
No contar las muertes
Al publicar muertes en el ensayo AstraZeneca, por ejemplo, los investigadores excluyeron cualquier muerte que ocurriera inmediatamente después de la primera dosis de la vacuna, hasta 14 días después de la segunda dosis de la vacuna.
En otras palabras: 1) primera inyección, 2) espere tres semanas antes de recibir la segunda inyección, 3) espere dos semanas más. Eso es un total de cinco semanas en las que no se publicaron las muertes.
Los investigadores dicen que se debe a que los participantes no son «completamente inmunes» hasta dos semanas después de su segunda dosis. Eso es verdad.
Sin embargo, ignorar las muertes en ese período de cinco semanas no captura ninguna muerte que pudiera ser causada por la vacuna.
El Dr. Healy fue muy crítico con este método de recopilación de datos.
“Se supone que los ensayos controlados aleatorios no permiten decisiones como esta. Se deben informar todas las muertes. La empresa puede decir que no cree que las muertes hayan sido causadas por la vacuna, pero necesitamos la oportunidad de saber cuántas hubo y decidir si es necesario investigar más ”, dijo el Dr. Healy.
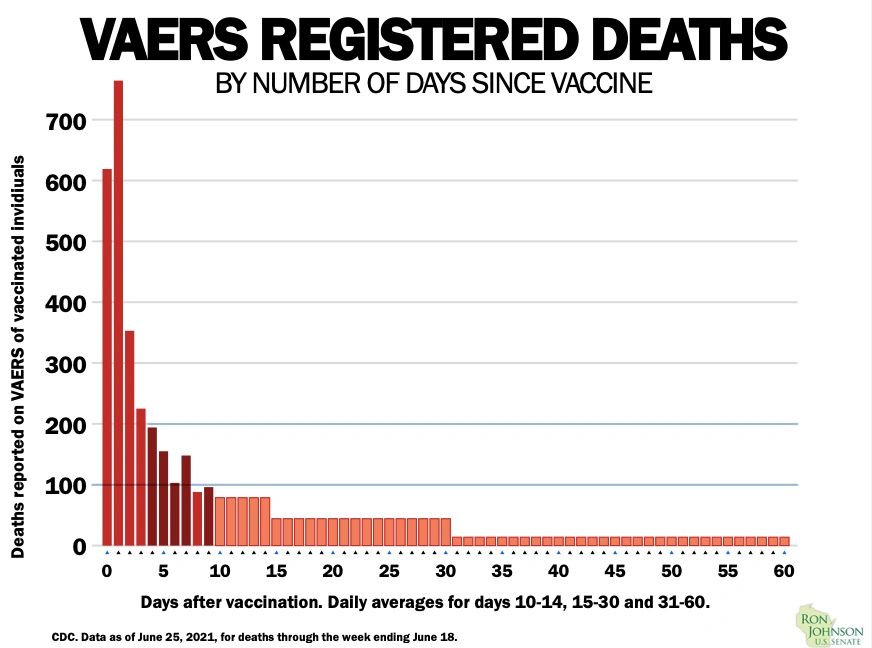
Es importante saber qué sucede en ese lapso de cinco semanas porque los datos del mundo real obtenidos de los CDC ( al 25 de junio de 2021 ) muestran que la mayoría de las muertes reportadas después de una vacuna Covid-19 ocurren dentro de los 30 días.
Estos datos de vigilancia no pueden establecer un vínculo causal con la vacuna , pero la señal se considera significativa, especialmente si las muertes no se capturan en los ensayos controlados.
La lección de los «ensayos controlados»
Los datos sobre la seguridad de las vacunas son tan importantes como la eficacia, aunque los medios de comunicación y los funcionarios de salud pública a menudo se centran en esta última.
Hasta ahora, no se han encontrado informes de eventos adversos graves y potencialmente mortales vinculados a las vacunas en los ensayos controlados del «estándar de oro». Solo se detectaron una vez que se habían vacunado cientos de miles de personas.
La miocarditis, por ejemplo, solo surgió en Israel una vez que comenzaron a distribuir la vacuna Pfizer a la población. Y los informes de trombocitopenia trombótica inducida por la vacuna (VITT) relacionada con la vacuna AstraZeneca surgieron por primera vez de los sistemas de vigilancia europeos, no de ensayos controlados.
Si todos los ensayos de la vacuna Covid-19 son financiados, diseñados, realizados y analizados por los fabricantes, lo que se sabe que distorsiona los resultados para favorecer los objetivos del patrocinador, entonces se debe hacer más para obtener acceso a los datos y permitir un escrutinio independiente.





